Ivan de Araujo:肠脑轴与行为控制
撰稿:谢冕,审核:陈良怡
2025年4月18日下午,受北京大学IDG麦戈文脑科学研究所邀请,马克斯-普朗克生物控制论研究所(Max Planck Institute for Biological Cybernetics)的Ivan de Araujo教授在金光生命科学大楼101报告厅作了题为“The Gut-Brain Axis and Behavioral Control”的学术报告。该报告由陈良怡教授主持。
Ivan de Araujo教授详细介绍了其课题组围绕小鼠肠道-大脑轴近年来开展的一系列工作,主题包括迷走神经信号对奖赏处理的影响,以及介导当代减肥药物强效作用的内感知机制等。
1. 纹状体多巴胺介导胃肠道改道导致的甜味食欲改变
减肥手术非常有益于减少卡路里摄入量,然而,胃肠道改道与糖分渴求减少之间的生理机制仍不确定。目前的证据表明,手术后甜味食欲的普遍下降并不是因为味觉感知出了问题,而是由于胃肠道改道导致的,给予肠道直接注射葡萄糖的小鼠仍然可以在行为学实验中激活对糖分的渴求。
前期工作已经表明,胃肠道的营养传感会刺激背侧纹状体的多巴胺大量外流1,基于这种胃肠道-纹状体多巴胺之间的联系,Ivan课题组利用十二指肠空肠旁路术(DJB)证实肠道改道会抑甜食欲,并得出结论:糖诱导的纹状体多巴胺激增通常依赖于在减肥干预中被绕过的特定肠段内的葡萄糖感应,以及手术后可通过人工激活纹状体多巴胺可兴奋细胞而唤起与饥饿无关的糖食欲2。
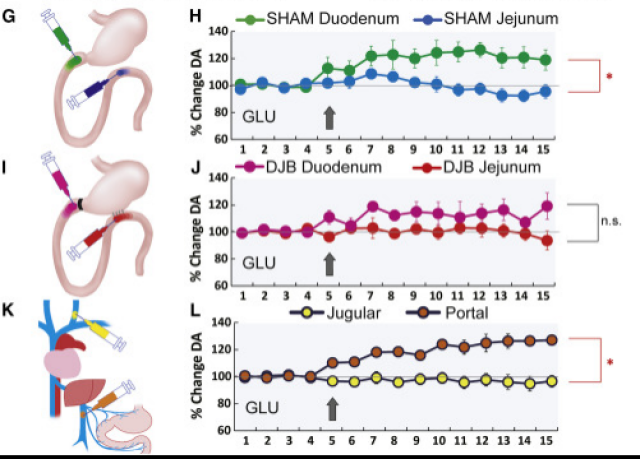
图1,葡萄糖通过十二指肠吸收到门静脉肝系统促进糖诱导的多巴胺释放
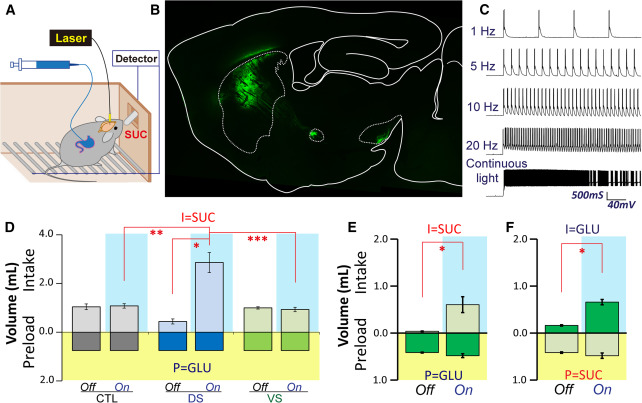
图2,纹状体背侧光遗传刺激抵消了十二指肠-空肠改道的食欲抑制作用
2. 光学激活肠道迷走神经感觉神经元可再现刺激大脑奖赏神经元的效果
然而,相关的肠脑神经元回路仍然未知。Ivan课题组在2018年的另一篇工作表明,右侧(而非左侧)迷走神经节的激活能维持自我刺激行为,调节味道和地点偏好,并诱导黑质释放多巴胺。
细胞特异性跨神经元追踪显示,迷走神经起源的不对称上升通路遍布整个中枢神经系统,例如,背外侧胫骨旁区域的谷氨酸能神经元是连接右侧迷走神经感觉神经节和黑质下多巴胺细胞的必经中继站。同样,通过光学激活腓肠肌旁-神经节投射可复制右迷走神经兴奋的奖赏效应。
其研究结果证实,迷走神经从肠道到大脑的轴是神经元奖赏通路的一个组成部分。这些研究还提出了治疗情感障碍的新型迷走神经刺激方法3。
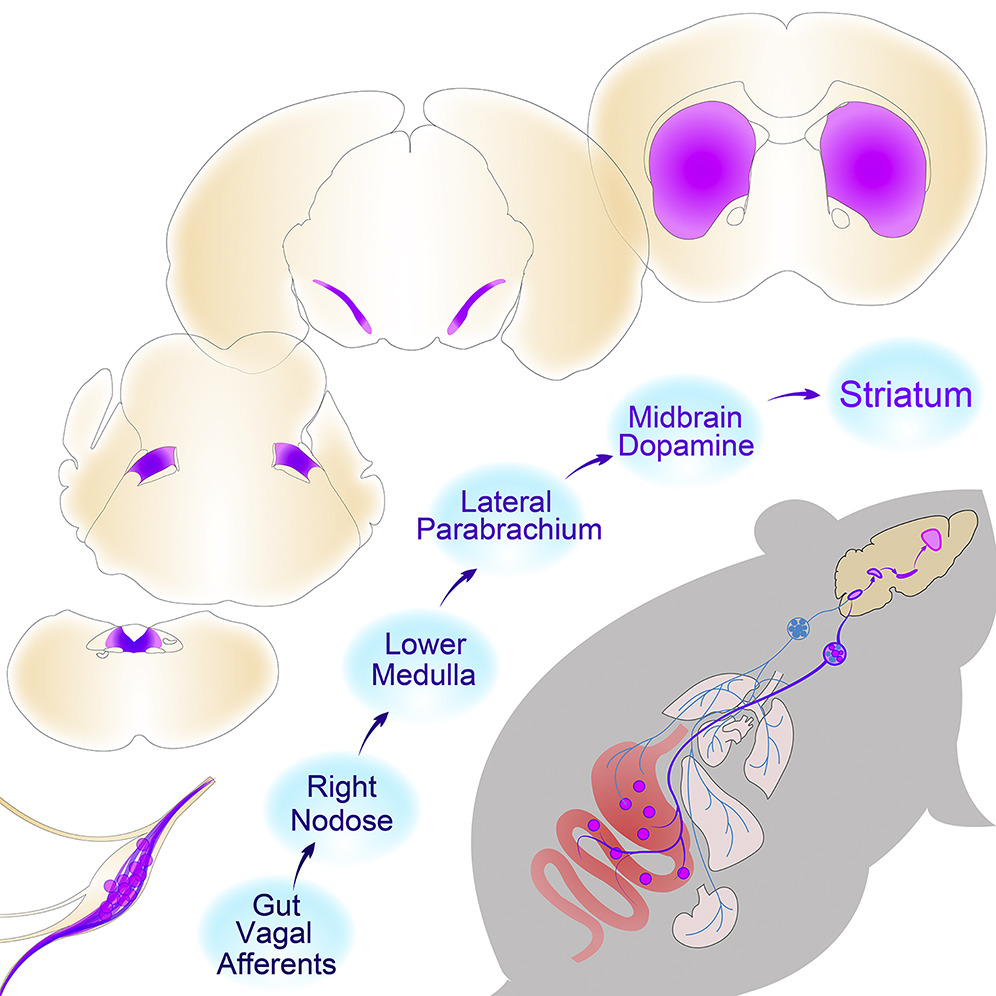
图3,肠道诱导奖励的神经回路
3. 抑制食欲的器官间神经回路
胰高血糖素样肽-1(GLP-1)是一种从下肠肠道内分泌细胞释放的信号肽,具有厌食和抗蠕动作用,可保护机体免受营养吸收不良的影响,然而人们对其如何影响远处器官却知之甚少。
Ivan教授课题组的研究表明,将 GLP-1 直接输注到回肠会降低胃动力和食欲,并导致胃体积显着增加一倍4。GLP-1是由肠道神经元,特别是由投射到腹部交感神经节的称为intestinofugal的特殊肠道神经元亚群检测到,这些神经节为胃肠道提供交感神经输入,接收来自回肠输入的交感神经元反过来投射到胃,在那里它们以表达抑制性Nos1的神经元为目标,这些神经元通过放松平滑肌来控制运动。因此,GLP-1可通过intestinofugal神经元抑制胃排空和进食,值得注意的是,特异性地消融intestinofugal神经元可消除GLP-1的作用,而它们的化学激活起了GLP-1模拟物的作用。
此外,intestinofugal神经元的GLP-1感知参与了交感-胃-脊髓-垂体-下丘脑通路,在这一途径中,细胞特异性激活离散神经元群会产生类似GLP-1的全身效应。该肠道回路可作为靶点改善典型的胃动力障碍引起的腹胀和食欲不振5。
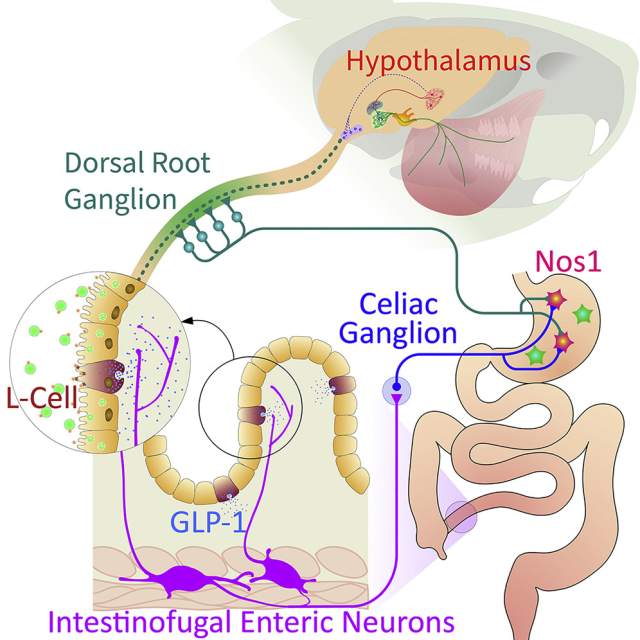
图4,抑制食欲的器官间神经回路
参考文献
1. The gut–brain dopamine axis: A regulatory system for caloric intake. Physiology & Behavior 106, 394–399 (2012).
2. Striatal Dopamine Links Gastrointestinal Rerouting to Altered Sweet Appetite. Cell Metabolism 23, 103–112 (2016).
3. Han, W. et al. A Neural Circuit for Gut-Induced Reward. Cell 175, 887–888 (2018).
4. Breaking down a gut-to-brain circuit that prevents malabsorption. Cell 185, 2393–2395 (2022).
5. An inter-organ neural circuit for appetite suppression. Cell 185, 2478-2494.e28 (2022).